日前,拟于在加拿大多伦多举办的第51届美国妇科肿瘤学会(SGO)年会因新冠疫情影响,被迫取消线下会议。SGO官网公布会议摘要内容,华中科技大学同济医学院附属同济医院高庆蕾教授团队6篇科研成果入选SGO壁报。高庆蕾教授团队在卵巢癌早期诊断及预后预测方面进行了深入研究。本文我们对相关内容及高庆蕾教授团队其他科研成果进行简要介绍。
1、【737 - Poster Session】Diagnosis and prognosis prediction of ovarian cancer with feedforward neural network by mining real-world laboratory tests
前馈神经网络通过真实世界实验室检测预测卵巢癌的诊断及预后
目的:卵巢癌一直是最具致死性的妇科恶性肿瘤,主要是因为缺乏有效的筛查策略。通过在真实世界中深度学习,我们旨在证明实验室检测在卵巢癌检测和预后预测中的价值。
方法:在这项回顾性多队列研究中,我们从3家大都市医院2012年1月1日至2019年5月30日期间的12,161名患者的电子病历中提取了来自51个实验室的455,599项测试结果。采用前馈神经网络(FNN)对2家医院的5009名患者的数据对诊断模型进行训练,然后分别在包含1253名和5899名患者的内部队列和独立外部队列中进行验证。我们从准确性、敏感性和特异性三个方面评估诊断模型的性能,并将它与CA-125进行比较。采用K型模型对预后进行预测。
结果:包含51个实验室项目组成的FNN诊断模型在卵巢癌诊断的内部验证(0.945、0.863、0.962)和外部验证(分别为0.912、0.639、0.915)中获得了较高的准确性、敏感性和特异性。在两组验证队列中,与CA1-25相比, FNN模型检测卵巢癌的特异性(0.956 vs 0.856,0.858 vs 0.882)相似,但准确性(0.933 vs 0.841,0.858 vs 0.785)和灵敏度(0.896 vs 0.811,0.842 vs 0.318)都有所提高。对于早期卵巢癌,在联合验证队列中,FNN模型与CA-125相比,在准确性(0.948 vs 0.811)、灵敏度(0.898 vs 0.412)和特异性(0.956 vs 0.900)方面表现出更好的诊断性能。此外,51个实验室项目组合采用K型模型在预测卵巢癌复发(HR=1.53,95%CI 1.15–2.05,P=0.0035)和生存期(HR=2.2 5,95%CI 1.45–3.50,P=0.0020)方面具有潜力。
结论:基于FNN模型的实验室检测具有卵巢癌筛查和预后预测的潜力,这一点值得进一步研究。
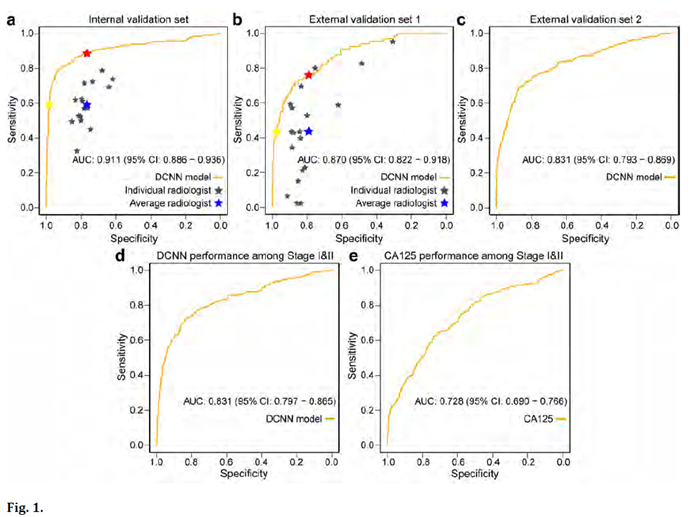
2、【740 - Poster Session】A deep convolutional neural network enabled pelvic ultrasound imaging algorithm for early and accurate diagnosis of ovarian cancer
深度卷积神经网络赋能的盆腔超声成像算法在卵巢癌早期准确诊断中的应用
目的:自从阴道超声出现以来,附件肿块的检出率大幅上升,而常规超声的准确性较低,往往导致过度治疗。现有检测手段限制了卵巢癌早期诊断,而早期诊断卵巢癌可显著提高患者生存率。我们旨在开发和验证深度卷积神经网络(DCNN)赋能模型,来提高基于卵巢癌的盆腔超声图像诊断的准确性。方法:2003年9月至2019年5月期间,该研究在10家医院共提取了107,624名女性(4254名卵巢癌和103,370名非卵巢癌)的592,275张超声图像。该模型基于8家医院的570,930张图像(105,079名女性),在同济医院的13,416张图像(1321名女性)的内部验证队列上进行测试,在外部验证队列1(荆州335名女性的1419张图像)和外部验证队列2(襄阳889名女性的6510张图像)上进行验证。受试者操作特性分析的准确性、敏感度、特异度、阴性预测值、阳性预测值和曲线下面积(AUC)与35名经验丰富的放射科医师和CA-125相比较。结果:在识别卵巢癌方面,该模型表现良好,内部验证队列的准确度、敏感度和特异度分别为0.889、0.793和0.932;外部验证队列1的准确度、敏感度和特异度分别为0.842、0.716和0.873;外部验队列2的准确度、敏感度和特异度分别为0.832、0.699和0.863。与内部和外部验证队列1的放射科医生的平均值相比,该模型在检测卵巢癌患者方面分别表现出更高的准确性(0.842 vs 0.735,0.858 vs 0.785)、灵敏度(0.750 vs 0.592,0.842 vs 0.318)和特异性(0.863 vs 0.767,0.806 vs 0.790)。在早期(FIGO I-II期)卵巢癌患者中,DCNN模型比CA125具有更高的特异性(0.836 vs 0.736)、敏感性(0.727 vs 0.624)和AUC(0.831 vs 0.728)。结论:与经验丰富的放射科医生和CA-125相比, DCNN赋能的盆腔超声成像在识别卵巢癌患者方面表现更佳,甚至在早期卵巢癌中也是如此。该模型的准确性和早期诊断值得进一步研究。
3、【736 - Poster Session】Ovarian cancer and pretreatment thrombosis-associated indices: Evidence based on multicenter, retrospective, observational study
卵巢癌与治疗前血栓形成相关指标的关系:一项多中心、回顾性、观察性循证研究
目的:多达20%的卵巢癌患者有血栓形成,这表明与血栓形成相关的物质与卵巢癌的病理生理有关。本研究旨在探讨治疗前测定的与血栓形成相关的指标与卵巢癌之间的关系。方法: 此项多中心、回顾性、观察性临床研究总共评估了12个与血栓相关的指标:血小板计数,血小板分布宽度,大型血小板比率,平均血小板体积,血小板压积,活性部分凝血活酶时间,抗凝血酶,凝血酶时间,凝血酶原时间活动度,凝血酶原时间,纤维蛋白原和国际标准化比值。2012–2019年间,本研究纳入3家医院共10,289名患者,其中包括1315名病理确诊的卵巢癌患者和8974名良性疾病患者。在卵巢癌患者中,805名患者有可及的生存时间。本研究从电子病历中提取治疗前指标。首先,我们通过t检验和逐步logistic回归来评估这些指标在区分卵巢癌患者和良性疾病患者中的价值。其次,采用Cox回归模型进行生存分析。结果:本研究中,t检验显示,除凝血酶时间外,各项指标在卵巢癌组与良性疾病组中均有显著性差异(P<0.005)。进一步将此11项指标及年龄输入逐步logistic回归模型进行分析。最终,血小板计数(OR=1.009,95%CI 1.006–1.011,P<0.0001),血小板分布宽度(OR=1.058,95%CI 0.993–1.128,P=0.0800),抗凝血酶(OR=0.984,95%CI 0.974–0.995,P=0.0031),纤维蛋白原(OR=1.207,95%CI 1.065–1.367,P=0.0032),年龄(OR=1.078,95%CI 1.065–1.092,P<0.0001)作为与卵巢癌相关的重要因素被纳入最终模型。接下来,将这5个因素与组织学类型、病理分级和FIGO分期一起进行生存分析。除年龄和FIGO分期外,Cox模型分析认为纤维蛋白原(HR=1.254,95%CI 1.127-1.396,P<0.0001)是总生存期的显著危险因素。结论:血栓相关指标是卵巢癌的潜在预测指标,其中血小板分布宽度、血小板计数、抗凝血酶和纤维蛋白原反映了卵巢癌的发病风险,纤维蛋白原与卵巢癌的总生存期相关。
4、【782 - Poster Session】Genetic testing procedures of BRCA1/2 mutation and their disparities: A national survey
BRCA1/2突变基因检测程序及其差异:一项全国调查
目的:虽然BRCA检测在卵巢癌和乳腺癌的治疗决策中是必需的,但中国目前还没有调查数据来确定BRCA测试的能力。因此,我们期望能发现中国各地不同实验室BRCA1和BRCA2检测程序的差异。方法:这项调查通过一个网站进行,目的是评估中国BRCA1和BRCA2的检测情况。所有调查信息通过研究网站分发给参与实验室。调查包括5个主要组成部分:提供实验室信息,BRCA1和BRCA2检测,胚系BRCA1和BRCA2检测,肿瘤组织BRCA1和BRCA2检测,以及变异解释。数据以频率和百分比的形式呈现。结果:共有62家基因检测实验室完成调查。最常用的二代测序(NGS)平台是Illumina(61.2%),其次是Thermo Fisher(24.1%)。除1个实验室外,所有实验室均能进行胚系BRCA1和BRCA2基因检测,而仅有80.6%的实验室具备进行肿瘤BRCA1和BRCA2基因检测的设施。Panel设计和测序参数在不同的实验室之间差别很大。在所有实验室中,由于探针设计的原因,46.8%的实验室没有检测到内含子区域的变化;大约40%的实验室没有检测到大片段重排。可以看到,在进行肿瘤BRCA1和BRCA2检测的实验室中,有12%的实验室没有对肿瘤细胞含量进行质量控制。实验室使用的翻译版指南存在差异,数据解释主要参考美国医学遗传学学会指南(90.3%),其次是中国专家共识(70.9%)。只有41.9%的实验室根据不同的方法评估不确定显著性变异率(VUS率)。大多数实验室(83.87%)没有与公共数据库共享数据,但是,它们愿意与国家机构共享数据。图1a和图1b显示了28个(胚系BRCA)和20个(肿瘤BRCA)实验室的质量分数。结论:尽管BRCA检测有巨大的需求,但它并没有统一的标准。中国需要强制的质量控制和具体的指导方针,以确保BRCA1和BRCA2基因检测实验室的质量保证。
5、【731 - Poster Session】Evolution of treatments for endometrial cancers: Clinical data from two national medical databases
子宫内膜癌的治疗演变:来自两个国家医学数据库的临床数据
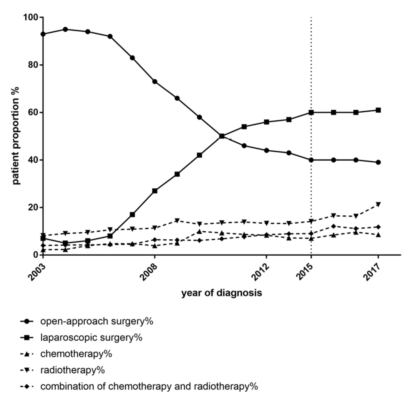
目的:本研究旨在展示近十年来子宫内膜癌患者的特征和治疗方法的演变,并评估临床数据在商业保险和医院数据库的一致性。方法:本研究在美国Open Claims商业保险数据库和基于医院记录的hospital CDM (Common Data Model)数据库中检索2003年至2018年间接受手术的子宫内膜癌患者数据,并将其转换为OHDSI (健康数据科学和信息) CDM。获取记录后,我们提取患者特征、手术方式(开腹或腹腔镜手术)、术后辅助治疗方案 (化疗、放疗或两者联合)进行分析。结果:总共有商业保险数据库中128,162名患者及医院CDM数据库中5,009名患者符合纳入标准。在商业保险数据库中,高血压、高脂血症和糖尿病是诊断子宫内膜癌前最常见的疾病,发生例数分别91,998(71.0%)、53,575(41.4%)和42,925(33.1%)。绝经后出血的发生率为51.3%。总计有66,268名患者接受了开腹手术,61,894名患者接受了腹腔镜手术。从2003年到2014年,接受腹腔镜手术的患者比例呈上升趋势,但自2015年以来相应比例停止增长。同时,在过去的十年里,接受术后辅助治疗的患者数量已从2003年的14.3%提高至2018年的41.6%,尤其是接受放化疗联合方案的患者 (2018年3.98%,2003年为11.8%)(图1)。在医院CDM数据库中也观察到类似的趋势。结论:高血压、糖尿病、高脂血症在子宫内膜癌患者中普遍存在,这些疾病可能与子宫内膜癌的发生发展有关。自2003年以来,接受腹腔镜手术和术后辅助治疗的患者数量有所增加。商业保险和医院病案数据库的临床数据分析具有较高的一致性,表明保险数据库具有良好的应用前景。
6、【312 - Poster Session】AIF1 drives tumor progression via a cellular cross-talk with the tumor microenvironment
目的:通过研究间质和上皮细胞(AIF1高表达的细胞类型)中AIF1表达模式、不同表达模式在肿瘤发生和转移中的分子学影响,以及肿瘤微环境的互通对卵巢癌肿瘤免疫的影响。方法:本研究将基因表达和甲基化的数据比对TCGA数据库和GEO数据库,进行间质来源和上皮来源的分类。收集患者成对的样本进行磁珠分离、CpG岛甲基化检测、连续切片免疫组化染色(IHC)和多色免疫荧光(IF)。共培养、Western blot、q-PCR和IF等实验均在体外进行。将AIF1基因在单核巨噬细胞中敲除或过表达,并与卵巢癌细胞系混合。结果:AIF1的基因表达水平与甲基化水平呈负相关,与正常卵巢细胞相比,AIF1在卵巢癌细胞中的表达水平较高。在基因表达谱和临床标本中,间质中AIF1的分布较上皮更为充分。亚组中卵巢癌间质中发现AIF1基因表达水平更高,同时甲基化水平更低。此外,肿瘤相关成纤维细胞中AIF1启动子区甲基化比例明显高于肿瘤上皮细胞和正常成纤维细胞。经thp-1和卵巢癌细胞系验证, AIF1主要来源于CD14单核细胞。值得注意的是,经IHC系列切片验证AIF1与PD-1、PD-L1、PD-L2、CTLA-4、Tim-3、CD11b有相关性。在RAW 264.7中过表达AIF1可通过细胞间的互通促进肿瘤微环境的形成,包括肿瘤血管生成、正常成纤维细胞激活、MDSC招募、M2转移、体内肿瘤进展等,而在thp-1中敲除AIF1则呈现相反的现象。结论:AIF1在卵巢癌间质和上皮细胞中表达不同。AIF1主要在单核细胞中高表达,AIF1在肿瘤基质中的成纤维细胞则主要处于高甲基化水平,这与免疫抑制、肿瘤血管生成、成纤维细胞活化有关。
声明:仅供医疗卫生专业人士使用和参考。本资料可能含有未经许可的产品或适应证信息,阿斯利康不建议您将产品用于未经许可的适应证。如果需要处方,请参考产品最新详细处方资料。
审批编号:CN-50208 有效期至:2021-4-8
华中科技大学附属同济医院妇瘤科副主任
国家“万人计划”创新领军人才
科技部“中青年科技创新领军人才”
中国抗癌协会肿瘤微环境专委会副主任委员
湖北省妇科肿瘤学会常务委员
主持科技部和湖北省重大专项基金各1项
主持5项国家自然科学基金
?





 京公网安备 11010502033352号
京公网安备 11010502033352号